KLASIFIKASI IKATAN
Jari-jari atom, sudut ikatan, dan elektron
valensi atom atau ion yang menyusun senyawa menentukan ikatan, struktur, reaksi
dan sifat fisik senyawa. Klasifikasi ikatan Ikatan yang menggunakan pasangan
elektron untuk mengikat atom A dan B disebut ikatan kovalen, dan ditulis
sebagai A-B atau A:B. Karena ada dua pasang elektron yang terlibat dalam ikatan
ganda dan tiga pasang di ikatan rangkap tiga, maka ikatan-ikatan tersebut
ditandai berturut-turut dengan A=B, A≡B atau A::B, A:::B. Ikatan kovalen sangat
sederhana, namun merupakan konsep yang sangat bermanfaat. Konsep ini diusulkan
oleh Gilbert Newton Lewis pada tahun 1916 yang disebut dengan struktur Lewis.
IKATAN IONIK (IKATAN ELEKTROVALEN) “TRANSFER ELEKTRON”
Atom logam (energi ionisasi rendah)
cenderung melepaskan elektronnya yang kemudian diterima oleh atom nonlogam
(afinitas elektron besar). Dalam proses transfer elektron dari atom logam ke
atom nonlogam ini akan terbentuk ion positif (kation) dan ion negatif (anion)
dengan konfigurasi electron gas mulia yang saling tarik-menarik dengan gaya
elektrostatis yang disebut sebagai ikatan ionik.
Sebagai contoh, dalam pembentukan senyawa ionik NaCl terjadi transfer elektron dari atom Na ke atom Cl :

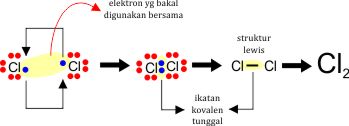
IKATAN KOVALEN "SHARING ELEKTRON"
Atom nonlogam cenderung tidak ingin
melepaskan elektronnya (energi ionisasi tinggi) dan ingin menarik elektron dari
atom lainnya (afinitas electron besar), sehingga terdapat satu atau lebih
pasangan elektron yang dipakai untuk dibagi bersama. Ikatan kimia yang
terbentuk dari sharing elektron yang terlokalisasi antara atom ini disebut
dengan ikatan kovalen.
Sebagai contoh, 2 atom H berikatan kovalen membentuk
molekul H2 dan 2 atom Cl yang berikatan kovalen membentuk molekul Cl2 :

FAKTOR GEOMETRI
Jari-jari atom dan kekuatan menarik elektron atom atau ion, menentukan ikatan, struktur, dan reaksi zat elementer dan senyawa.
1. Jari-jari Atomik dan Ionik





 Jari-jari
anion rX adalah separuh sisi polihedral
dan jarak kation di pusat polihedral ke sudut polihedral adalah jumlah
jari-jari kation dan anion rX + rM. Polihedra dalam CsCl adalah kubus, struktur NaCl adalah oktahedral, dan
ZnS adalah tetrahedral. Jarak dari pusat ke sudut polihedral adalah
berturut-turut √3rX, √2 rX dan ½√6rX. Sehingga, rasio jari-jari kation dan anion adalah are (√3rX-rX)/ rX = √3-1 = 732 untuk CsCl, (√2rX-rX)/ rX = √2-1 = 0.414 untuk NaCl, dan
(½√6rX-rX)/ rX = ½√6-1 = 0.225 untuk ZnS.
Jari-jari
anion rX adalah separuh sisi polihedral
dan jarak kation di pusat polihedral ke sudut polihedral adalah jumlah
jari-jari kation dan anion rX + rM. Polihedra dalam CsCl adalah kubus, struktur NaCl adalah oktahedral, dan
ZnS adalah tetrahedral. Jarak dari pusat ke sudut polihedral adalah
berturut-turut √3rX, √2 rX dan ½√6rX. Sehingga, rasio jari-jari kation dan anion adalah are (√3rX-rX)/ rX = √3-1 = 732 untuk CsCl, (√2rX-rX)/ rX = √2-1 = 0.414 untuk NaCl, dan
(½√6rX-rX)/ rX = ½√6-1 = 0.225 untuk ZnS.
Variasi Ungkapan Struktur Padatan
Banyak padatan anorganik memiliki struktur 3-dimensi yang rumit. Ilustrasi yang berbeda dari senyawa yang sama akan membantu kita memahami struktur tersebut. Dalam hal senyawa anorganik yang rumit, menggambarkan ikatan antar atom, seperti yang digunakan dalam senyawa organik biasanya menyebabkan kebingungan. Anion dalam kebanyakan oksida, sulfida atau halide logam membentuk tetrahedral atau oktahedral di sekeliling kation logam. Walaupun tidak terdapat ikatan antar anion, strukturnya akan disederhanakan bila struktur diilustrasikan dengan polihedra anion yang menggunakan bersama sudut, sisi atau muka. Dalam ilustrasi semacam ini, atom logam biasanya diabaikan. Seperti telah disebutkan struktur ionik dapat dianggap sebagai susunan terjejal anion.













DAFTAR PUSTAKA

1. Jari-jari Atomik dan Ionik
a. Jari-jari Atomik
Kerapatan elektron dalam atom secara perlahan akan menuju, tetapi tidak pernah mencapai nol ketika jarak dari inti meningkat. Oleh karena itu, dapat dinyatakan bahwa jari-jari atom tidak dapat ditentukan. Jari-jari atomik yang ditentukan secara eksperimen merupakan salah satu parameter atomik yang sangat penting untuk mendeskripsikan kimia struktural senyawa. Jari-jari logam secara eksperimen merupakan separuh jarak antar inti atom. Separuh jarak antar atom didefinisikan juga sebagai jari-jari kovalen zat elementer.
b. Jari-jari Ionik
Jari-jari
ion adalah jari-jari ion atom. Ion tidak bisa hidup sendiri. Jika ion bermuatan
positif, ion ini akan bereaksi dengan ion yang bermuatan negatif atau
sebaliknya, dan menjadi senyawa netral stabil. Senyawa ini disebut senyawa ion
karena terbuat dari komponen ion. Senyawa ion terdiri dari kation dan anion.
Ukuran kation lebih kecil karena kation dibentuk dengan membuang satu atau
lebih elektron dari atom. Anion besar karena memiliki elektron ekstra yang
dipukul oleh nukleus, sehingga terjadi peningkatan jarak antara nukleus dan
elektron terjauh dari awan elektron.

2. Entalpi Kisi
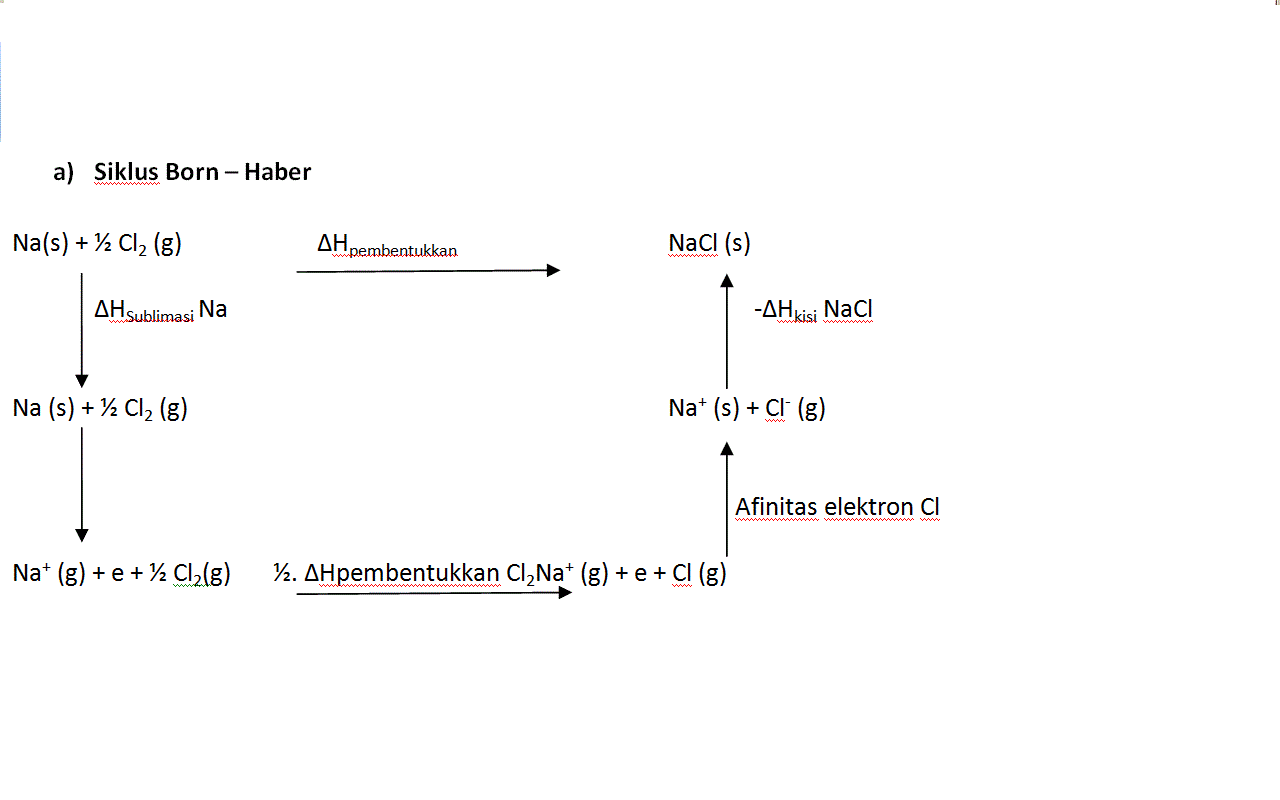
Siklus Born Haber adalah suatu pendekatan yang digunakan untuk menganalisis energi reaksi. Pendekatan ini diberi nama oleh dua ilmuwan Jerman Max Born dan Fritz Haber yang mengembangkan pendekatan ini pada tahun 1919. Siklus ini berkaitan dengan pembentukan senyawa ionik dari reaksi logam (utamanya unsur golongan I atau golongan II) dengan halogen atau unsur non logam lainnya seperti oksigen.
Siklus Born Haber digunakan terutama sebagai cara untuk menghitung energi kisi, atau lebih tepatnya entalpi yang tidak bisa diukur secara langsung. Entalpi kisi adalah perubahan entalpi yang terlibat dalam pembentukan senyawa ionik dari ion berfasa gas, atau kadang didefinisikan sebagai energi untuk memecah senyawa ion menjadi ion berfasa gas. Siklus Born Haber menerapkan hukum Hess untuk menghitung entalpi kisi dengan membandingkan perubahan entalpi dari senyawa ionik ke entalpi yang diperlukan untuk membuat ion berfasa gas dari unsur bebasnya.
Untuk memutuskan ion-ion bebas dari kisi membutuhkan energi yang besar. Nilai dari energi kisi bergantung pada kekuatan ikatan ion. Kekuatan ion berkaitan erat dengan ukuran dan muatan ion. Ketika ion-ion dalam keadaan gas bereaksi satu dengan yang lainnya membentuk senyawa kemudian melepaskan entalpi atau mengubah nilai entalpi, itulah yang disebut entalpi kisi. Sebagai contoh adalah pembentukan NaCl yang biasanya melepaskan kalor ke lingkungan:
Na+ (g) + Cl - (g) ⇌ NaCl (s)

3. Tetapan Madelung
Tetapan Madelung atau konstanta Madelung digunakan dalam menentukan potensial elektrostatik dari ion tunggal dalam kristal dengan cara memperkirakan ion dengan muatan titik. Tetapan ini diberi nama oleh Erwin Madelung, seorang ahli fisika asal Jerman. Energi potensial Coulomb total antar ion dalam senyawa ionik yang terdiri atas ion A dan ion B adalah penjumlahan energi potensial Coulomb interaksi ion individual. Karena anion dan kation dalam padatan ionik saling tarik-menarik karena muatan yang berlawanan, pemisahan ion memerlukan sejumlah energi. Energi ini harus diberikan kepada sistem untuk memutuskan ikatan anion dan kation. Energi yang diperlukan untuk memutuskan ikatan-ikatan ini untuk satu mol padatan ionik dalam kondisi standar disebut sebagai energi kisi.
Lokasi ion-ion dalam kristal ditentukan oleh tipe struktur potensial Coulomb total antar ion dihitung dengan menentukan jarak antar ion d. A adalah Tetapan Madelung yang khas untuk tiap kristal. Interaksi elektrostatik antara ion-ion yang bersentuhan merupakan yang terkuat dan tetapan Madelung juga akan meningkat dengan semakin besarnya bilangan koordinasi.
Susunan Hexagonally Close Packed (HCP)

Sel satuan HCP adalah prisma rhombohedral yang mengandung dua bola yang terletak pada posisinya.
Susunan Cubic Close Packed (CCP)
Jika diiris, CCP tampak seperti FCC (face centered cubic), mengandung bola disetiap sudut kubus dan satu dipusat muka.
Aturan Jari-jari
 Jari-jari
anion rX adalah separuh sisi polihedral
dan jarak kation di pusat polihedral ke sudut polihedral adalah jumlah
jari-jari kation dan anion rX + rM. Polihedra dalam CsCl adalah kubus, struktur NaCl adalah oktahedral, dan
ZnS adalah tetrahedral. Jarak dari pusat ke sudut polihedral adalah
berturut-turut √3rX, √2 rX dan ½√6rX. Sehingga, rasio jari-jari kation dan anion adalah are (√3rX-rX)/ rX = √3-1 = 732 untuk CsCl, (√2rX-rX)/ rX = √2-1 = 0.414 untuk NaCl, dan
(½√6rX-rX)/ rX = ½√6-1 = 0.225 untuk ZnS.
Jari-jari
anion rX adalah separuh sisi polihedral
dan jarak kation di pusat polihedral ke sudut polihedral adalah jumlah
jari-jari kation dan anion rX + rM. Polihedra dalam CsCl adalah kubus, struktur NaCl adalah oktahedral, dan
ZnS adalah tetrahedral. Jarak dari pusat ke sudut polihedral adalah
berturut-turut √3rX, √2 rX dan ½√6rX. Sehingga, rasio jari-jari kation dan anion adalah are (√3rX-rX)/ rX = √3-1 = 732 untuk CsCl, (√2rX-rX)/ rX = √2-1 = 0.414 untuk NaCl, dan
(½√6rX-rX)/ rX = ½√6-1 = 0.225 untuk ZnS.Variasi Ungkapan Struktur Padatan
Banyak padatan anorganik memiliki struktur 3-dimensi yang rumit. Ilustrasi yang berbeda dari senyawa yang sama akan membantu kita memahami struktur tersebut. Dalam hal senyawa anorganik yang rumit, menggambarkan ikatan antar atom, seperti yang digunakan dalam senyawa organik biasanya menyebabkan kebingungan. Anion dalam kebanyakan oksida, sulfida atau halide logam membentuk tetrahedral atau oktahedral di sekeliling kation logam. Walaupun tidak terdapat ikatan antar anion, strukturnya akan disederhanakan bila struktur diilustrasikan dengan polihedra anion yang menggunakan bersama sudut, sisi atau muka. Dalam ilustrasi semacam ini, atom logam biasanya diabaikan. Seperti telah disebutkan struktur ionik dapat dianggap sebagai susunan terjejal anion.

P4CO10

MoCl5
Kristal Ionik
Struktur dasar kristal ion adalah ion yang lebih besar (biasanya anion) membentuk susunan terjejal dan ion yang lebih kecil (biasanya kation) masuk kedalam lubang oktahedral atau tetrahedral diantara anion. Kristal anion diklasifikasikan kedalam beberapa tipe struktur berdasarkan jenis kation dan anion yang terlibat dan jari-jari ionnya.



Dalam HCP dan CCP terdapat lubang diantara boa-bola yang terdapat lubang Ob (oktahedral) dikelilingi 6 bola atau lubang Tb (tetrahedral) dikelilingi 4 bola. Dalam padatan ionik, bila anion dalam susunan HCP atau CCP, kation masuk melalui lubang-lubang ini.
Struktur Kristal Logam
Ikatan antar teras atom atau orbital atom yang terisi penuh elektron bersama-sama inti atom yang dikelilingi oleh elektron-elektron bebas.

Struktur atom dalam sebuah kristal heksagonal terpadatkan dan rapat (HCP).
FAKTOR ELEKTRONIK
Sifat elektronik menentukan ikatan dan unsur senyawa seperti kekuatan atom-atom penyusun dalam menarik dan menolak elektron. Orbital elektron yang diisi elektron valensi, susunan geometrisnya dipengaruhi oleh interaksi elektronik antar elektron non ikatan.
1. Muatan Inti Efektif
Karena muatan positif inti biasanya sedikit banyak dilawan oleh muatan negatif elektron dalam (di bawah elektron valensi), muatan inti yang dirasakan oleh elektron valensi suatu atom dengan nomor atom Zakan lebih kecil dari muatan inti, Ze. Penurunan ini diungkapkan dengan konstanta perisai (σ) dan muatan inti netto disebut dengan muatan inti efektif (zeff).
Persamaan : Zeff = Z – σ
2. Energi Ionisasi
Energi ionisasi didefinisikan sebagai energi minimum yang diperlukan untuk mengeluarkan elektron dari atom dalam fase gas (g), sebagaimana ditunjukkan dalam persamaan berikut :
A(g) → A+ (g) + e (g)
Energi ionisasi diungkapkan dalam satuan elektron volt (eV), 1 eV = 96.49 kJmol-1. Energi ionisasi pertama yang mengeluarkan elektron terluar merupakan energi ionisasi terendah, dan energi ionisasi kedua dan ketiga, yang mengionisasi lebih lanjut kation, meningkat dengan cepat. Entalpi ionisasi, yakni perubahan entalpi standar proses ionisasi dan digunakan dalam perhitungan termodinamika adalah energi ionisasi yang ditambah dengan RT (R adalah tetapan gas 8.31451 JK-1mol-1 dan T adalah temperatur, 2.479 kJ (0.026 eV), pada suhu kamar).
3. Afinitas Elektron
Afinitas elektron adalah energi yang dilepaskan atau yang diperlukan saat masuknya elektron ke dalam atom atau ion dalam fase gas. Afinitas elektron merupakan perubahan entalpi ketika suatu atom pada fase gas menerima elektron dari luar membentuk suatu anion. Nilai afinitas elektron dinyatakan dalam per mol atom atau mol ion. Persamaan : A(g) + e → A-(g)
KE-ELEKTRONEGATIFAN
1. L. Pauling
Ke-elektronegatifan adalah salah satu parameter atom paling fundamental yangmengungkapkan secara numerik kecenderungan atom untuk menarik elektron dalam molekul. Kelektronegatifan sangat bermanfaat untuk menjelaskan perbedaan dalam ikatan, struktur, dan reaksi dari sudut pandang sifat atom.

2. A. L. Allred dan E. G. Rochow
A. L. Allred dan E. G. Rochow mendefinisikan ke-elektronegativan sebagai medan listrik dipermukaan atom. Mereka menambahkan konstanta untuk membuat keelektronegativan mereka χAR sedekat mungkin dengan nilai Pauling dengan menggunakan r adalah jari-jari ikatan kovalen atom. Unsur-unsur dengan jari-jari kovalen yang kecil dan muatan inti efektif yang besar memiliki ke-elektronegatifan yang besar.
3. R. Mulliken
R. Mulliken mendefinisikan ke-elektronegativan χM sebagai rata-rata energi ionisasi I dan afinitas elektron A . Persamaan : χM = ½ (I+A).
Energi ionisasi adalah energi eksitasi dari HOMO dan afinitas elektron adalah energi penambahan elektron ke LUMO. Sehingga ke-elektronegatifan adalah rata-rata energi HOMO dan LUMO.

Orbital Molekul
Fungsi gelombang elektron dalam suatu atom disebut orbital atom. Karena kebolehjadian menemukan elektron dalam orbital molekul sebanding dengann kuadrat fungsi gelombang dan peta elektron nampak seperti fungsi gelombang.
Suatu gelombang fungsi memiliki daerah yang beramplitudo positif dan negatif yang disebut cuping (lobes).
1. Cuping (lobes) orbital atom penyusunannya cocok untuk tumpang tindih.
2. Tanda positif atau negatif cuping (lobes) yang bertumpang tindih sama.
3. Tingkat energi orbital-orbital atomnya dekat.


DAFTAR PUSTAKA
Baru, Orde. 2016. Ikatan Kimia.
Sinaga, Dian. 2019. Ikatan Kimia.
Sinurat, Rosani. 2016. Ikattan
Kimia.

Oleh :
Nama : Christy Meideiva Koswara
NIM : C1061191098
Program Studi : Ilmu dan Teknologi
Pangan
UNIVERSITAS TANJUNGPURA PONTIANAK



Bagus kk
ReplyDeleteKeren kak
ReplyDeletebagus banget kakak 👍👍👍
ReplyDeleteGood
ReplyDeleteBaguss Kakk
ReplyDeleteBaguss
ReplyDeleteBagus kk
ReplyDelete👍👍
ReplyDeleteGooodd
ReplyDelete👍👍👍
ReplyDeletemantul
ReplyDeleteNtaps
ReplyDeleteKeren
ReplyDeleteBagus👍
ReplyDeleteBaguss👌
ReplyDelete⭐⭐⭐⭐⭐
ReplyDelete������
ReplyDelete