ASAM DAN BASA
Asam dan basa adalah dua golongan zat kimia yang sangat umum ditemukan di sekitar kita. Sebagai contoh, cuka, asam sitrun, dan asam dalam lambung tergolong asam, sedangkan kapur sirih dan soda api tergolong basa. Asam dan basa memiliki sifat-sifat yang berbeda. Pada mulanya, asam dan basa dibedakan berdasarkan rasanya, di mana asam terasa masam sedangkan basa terasa pahit. Namun, secara umum zat-zat asam maupun basa bersifat korosif dan beracun, khususnya dalam bentuk larutan dengan kadar tinggi sehingga sangat berbahaya jika diuji sifatnya dengan metode dirasa atau dicicip. Dari berbagai teori definisi asam basa yang pernah diajukan, terdapat tiga teori yang sangat bermakna, antara lain teori asam basa Arrhenius, teori asam basa Brønsted–Lowry, dan teori asam basa Lewis.
1. Teori Asam-Basa Arrhenius
Teori asam basa Arrhenius dikemukakan oleh Svante August Arrhenius pada tahun 1884. Menurut Arrhenius, definisi dari asam dan basa, yaitu : - Asam adalah senyawa yang jika dilarutkan ke dalam air akan melepaskan H+ - Basa adalah senyawa yang jika dilarutkan ke dalam air akan melepaskan OH−
Menurut teori asam basa Arrhenius, asam kuat merupakan asam yang derajat ionisasinya besar atau mudah terurai dan banyak menghasilkan ion H+ dalam larutannya. Asam kuat diantaranya HCl, HBr, HI, H2SO4, HNO3, dan HClO4. Menurut teori asam basa Arrhenius, terdapat basa kuat dan basa lemah. Basa kuat merupakan basa yang mudah terionisasi dalam larutannya dan banyak mengahsilkan ion OH–. Contohnya KOH, NaOH, Ba(OH)2, dan Ca(OH)2.


2. Teori Asam-Basa Brønsted–Lowry
Pada tahun 1923, Johannes N. Brønsted dan Thomas M. Lowry secara terpisah mengajukan definisi asam dan basa yang lebih luas. Konsep yang diajukan tersebut didasarkan pada fakta bahwa reaksi asam–basa melibatkan transfer proton (ion H+) dari satu zat ke zat lainnya. Proses transfer proton ini selalu melibatkan asam sebagai pemberi/donor proton dan basa sebagai penerima atau akseptor proton. Jadi, menurut Brønsted–Lowry, definisi asam-basa ialah : - Asam adalah donor proton. - Basa adalah akseptor proton.
Teori Bronsted Lowry merupakan perluasan teori Arrhenius. Ion hidroksida tetap berlaku sebagai basa karena ion hidroksida menerima ion hidrogen dari asam dan membentuk air. Asam menghasilkan ion hidrogen dalam larutan karena asam bereaksi dengan molekul air melalui pemberian sebuah proton pada molekul air.
Sebagai contoh gas
hidrogen klorida (HCl) di larutkan dalam air, maka molekul hidrogen klorida
akan memberikan sebuah proton (ion H+) ke molekul air.
Ikatan kovalen koordinasi terbentuk antara satu pasangan mandiri pada oksigen
dengan hidrogen dari HCl dan menghasilkan ion hidroksonium, H3O + H2 +
HCl → H3O
+ Cl
Ketika asam yang terdapat dalam larutan bereaksi
dengan basa, yang berfungsi sebagai asam adalah ion hidroksonium. Sebagai
contoh, proton di transferkan dari ion hidroksonium ke ion hidroksida untuk
mendapatkan air.
H3 O+(aq) +
OH–(aq) →
2H2O(ℓ)
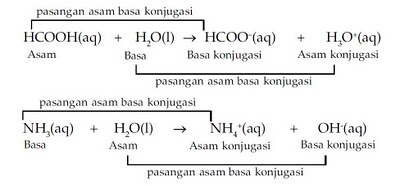
Pada reaksi asam basa Bronsted – Lowry, terdapat 2
pasangan asam basa. Pasangan pertama merupakan pasangan antara asam dengan basa
konjugasi (yang menyerap proton), dalam hal ini di tandai dengan asam – 1 dan
basa – 1.
Pasangan
kedua adalah pasangan antara basa dengan asam konjugasi (yang memberi proton),
dalam hal ini di tandai dengan basa -2 dan asam – 2. Rumusan kimia pasangan
asam basa konjugasi hanya berbeda satu proton (H+).
Pada tahun 1923, G. N. Lewis mengemukakan teori asam-basa yang
lebih luas dibanding kedua teori sebelumnya dengan menekankan pada pasangan
elektron yang berkaitan dengan struktur dan ikatan. Definisi asam-basa
Lewis ialah :
- - Asam adalah sebagai akseptor pasangan
elektron.
- - Basa adalah sebagai donor
pasangan elektron.
Berdasarkan definisi Lewis, asam yang berperan sebagai penerima pasangan elektron tidak hanya H+. Senyawa yang
memiliki orbital kosong pada kulit valensi seperti BF3 juga dapat berperan sebagai asam. Sebagai
contoh, reaksi antara BF3dan NH3 merupakan reaksi asam–basa, di mana BF3 sebagai asam Lewis dan NH3sebagai basa Lewis. NH3 memberikan
pasangan elektron kepada BF3 sehingga
membentuk ikatan kovalen koordinasi antara keduanya.



Oleh :
Nama : Christy Meideiva Koswara
NIM : C1061191098
Program Studi : Ilmu dan Teknologi Pangan
UNIVERSITAS TANJUNGPURA PONTIANAK
Kewren kk
ReplyDeleteMudah dipahami��
ReplyDelete